Apesar do avanço do conceito plant-based, o mundo não só continuará a comer alimentos de origem animal, como o fará em quantidades ainda maiores.
Avaliado em US$ 44 bilhões, em 2021, o mercado global está previsto movimentar quase US$ 73 bilhões, nos próximos sete anos. Só de carne, nos últimos 60 anos, o consumo per capita saltou de 24 para 46 quilos anuais.
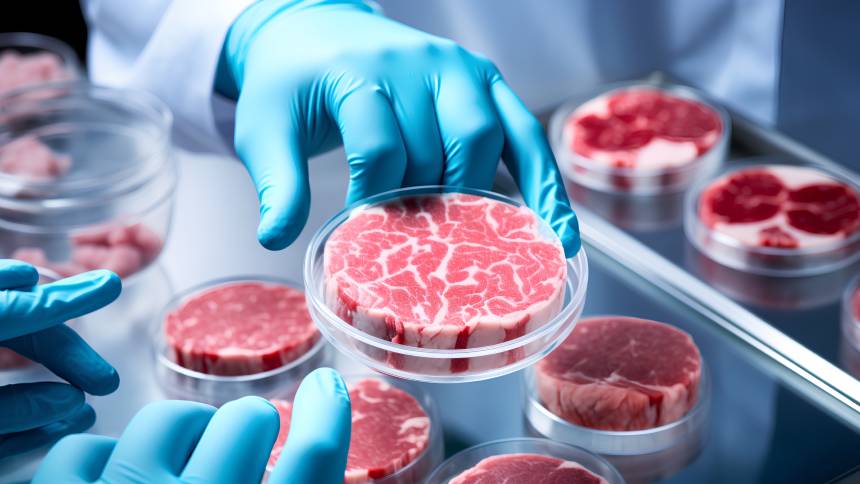
E a carne cultivada surge como alternativa. E com uma vantagem sobre as chamadas “carnes verdes”, é carne de verdade, fundamental para conquistar os consumidores não veganos. Em laboratório, os cientistas cultivam as células de um boi e as transformam em um filé – sem nenhum prejuízo ao bem-estar do animal ou danos ao meio ambiente.
Seria uma maravilha, não fosse o processo de produção de carne cultivada tão caro. Desenvolvido em meados da década de 2010, o método tradicional envolve gigantescos biorreatores. Nesses tanques de aço inoxidável, micróbios, geneticamente modificados, funcionam como fábricas invisíveis de proteínas recombinantes, os fatores de crescimento para as culturas de células animais.
Para se ter ideia, o primeiro hamburguer de laboratório, apresentado ao mundo, em 2013, em Londres. custou US$ 325 mil. De lá para cá, os custos diminuíram, mas ainda não encontram paridade de preço com a carne tradicional.

O casal de canadenses Matt e Jalene Anderson-Baron, porém, encontrou uma unidade fabril mais econômica e rápida para a produção dos compostos de crescimento: a popular mosca-da-fruta, que tem o nome científico de Drosophila melanogaster (D. mel.).
Fundadores da biotech Future Fields, eles desenvolveram a EntoEngine. Em vez dos biorreatores necessários para alimentar os microrganismos, os insetos podem ser mantidos em recipientes comuns de plástico.
Além disso, as moscas são mais resilientes do que as frágeis bactérias e leveduras, diz Matt, em entrevista ao site AgFunder News. Os animais possuem ainda uma maquinaria para a produção de proteínas mais sofisticada do que a dos micróbios, alguns dos seres mais primitivos do planeta.
Ou seja, adaptar o DNA das moscas para que os animais fabriquem as substâncias desejadas é mais simples. Com isso, a qualidade do produto final tende a ser maior. No genoma da D.mel., em fase embrionária, os cientistas da Future Fields inserem o gene da proteína a ser expressa. Quando as moscas crescem, passam a secretar a proteína recombinante. O material é então colhido e purificado.
Primeira fábrica
Lançada em 2018, na cidade de Edmond, em Alberta, a empresa já levantou quase US$ 19 milhões, conforme levantamento da plataforma Crunchbase. Entre os investidores estão Bee Partners Toyota Ventures, Builders VC, AgFunder, Amplify Capital, Green Circle Foodtech, Siddhi Capital, Climate Capital e o neurocientista Milad Alucozai da BoxOne Ventures.
No início de 2024, a primeira fábrica da Future Fields deve ser inaugurada. Nas contas dos Anderson-Baron, a empresa já conta com cerca de 60 clientes. A maioria, empresas de agricultura celular, mas as moscas da startup canadense também fornecem material para os mercados biofarmacêutico e de pesquisas clínicas.
Avaliado em US$ 200 milhões, o mercado global de carne cultivada cresceu 16,1% apenas em 2023. Até 2034, deve bater US$ 1,1 bilhão, lê-se em relatório da Markets and Markets.
Divulgado em setembro passado, o relatório do Congressional Research Service, o instituto de pesquisas de políticas públicas do Congresso americano, indica que há cerca de 150 foodtechs de carne cultivada, no mundo. Apenas dois países aprovaram o comércio do produto – Cingapura, em 2020, e Estados Unidos, em julho de 2023, para o frango da UPSIDE Foods.

Segundo um estudo da consultoria McKinsey, a tecnologia de biofabricação tem o potencial para liberar até US$ 4 trilhões por ano, nas próximas duas décadas. Mas, é preciso pensar além dos micróbios.
Para atender a demanda de um mercado em ritmo acelerado de expansão, até 2030, os biorreatores devem produzir, no mundo todo, 10 bilhões de litros de proteínas recombinantes. A capacidade instalada hoje, porém, é de 61 milhões de litros. Soluções como as moscas da Future Fields podem fazer a diferença.
US$ 3 mil por meio quilo de nugget
No início do negócio, Matt, atual CEO, Jalene, COO, e o também cofundador Lejy Gafour pensavam em criar uma empresa de carnes de aves cultivadas. O primeiro MVP (sigla em inglês para Produto Viável Mínimo), um nugget de frango, acabou saindo US$ 3 mil, meio quilo. Eles então decidiram focar nas proteínas recombinantes.
Escolheram a D. mel por ser um dos animais mais estudados pela ciência. O interesse pela mosca vem de quase um século, por suas semelhanças genéticas com os seres humanos. O inseto tem quatro pares de cromossomos e cerca de 14 mil genes. Os humanos possuem 22,5 mil, aproximadamente. E nas leveduras, não chegam a 6 mil.
Desde 1933, quando Thomas Hunt Morgan ganhou um prêmio Nobel por estudar como a mosca-das-frutas recebia de herança a mutação responsável por deixar seus olhos brancos, e não vermelhos, as investigações em torno do bicho já renderam a 11 pesquisadores, em seis ocasiões diferentes, a honraria máxima da Academia Real das Ciências da Suécia.